25/01/2018
DES CELLULES SOUCHES A UN COEUR FONCTIONNEL: LE RÔLE DU GENE Mesp1
First release Science Report: Les chercheurs de l’Université libre de Bruxelles et de l’Université de Cambridge ont découvert le rôle du gène clé Mesp1 dans les étapes les plus précoces de la formation du coeur lors de l’embryogénèse. Cette découverte pourrait aider à mieux comprendre les malformations cardiaques congénitales.
Le coeur est le premier organe formé au cours de l’embryogénèse. Il est constitué de plusieurs types cellulaires ayant des fonctions bien spécifiques : les cardiomyocytes, cellules assurant le battement du coeur, les cellules vasculaires tapissant l’intérieur des chambres et les vaisseaux sanguins et les cellules pacemakers assurant le rythme cardiaque. De très graves malformations cardiaques peuvent survenir si les cellules progénitrices à l’origine du coeur ne sont pas spécifiées au bon moment, ne migrent pas au bon endroit et ne se différencient pas correctement. Chez l’homme, les malformations cardiaques congénitales,
issues de défauts lors des étapes précoces du développement, représentent la cause la plus fréquente de mort à la naissance.
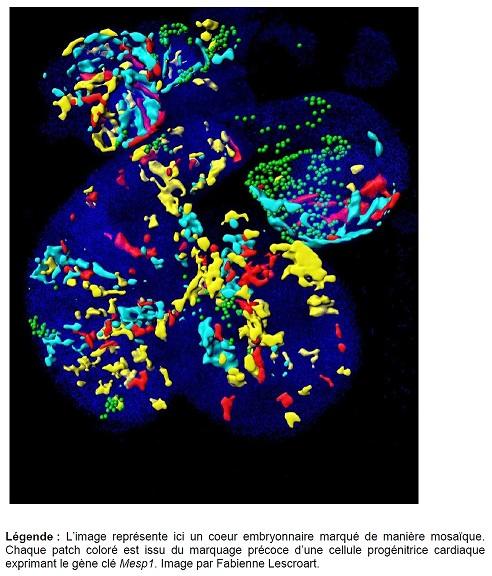
Des études précédentes ont montré que les cellules progénitrices cardiaques étaient issues de différentes populations de cellules exprimant un gène clé, Mesp1. Cependant, il restait à comprendre ce qui différenciait moléculairement ces populations distinctes et quels étaient les mécanismes moléculaires qui permettaient d’orienter les cellules progénitrices vers une région ou un type cellulaire particulier. Dans une nouvelle étude publiée dans la revue Science, les chercheurs dirigés par Cédric Blanpain, de l’Université libre de Bruxelles, et par Berthold Göttgens, de l’Université de Cambridge, ont identifié le rôle de Mesp1 dans les étapes les plus précoces de la spécification cardiovasculaire et ont défini les caractéristiques moléculaires des différentes populations de cellules progénitrices cardiaques. Ils ont pour cela utilisé la technologie de pointe de séquençage de tous les gènes exprimés par chaque cellule unique.
Fabienne Lescroart et ses collègues ont d’abord isolé, à différentes étapes du développement embryonnaire, les cellules progénitrices à l’origine du coeur exprimant Mesp1. Ils ont ensuite réalisé une analyse des gènes exprimés par chacune des cellules uniques afin d’identifier les caractéristiques moléculaires des cellules progénitrices associées avec une région ou un type cellulaire cardiaque particulier. Ils ont ainsi démontré que les différentes populations de progéniteurs cardiaques sont moléculairement distinctes. Afin de déterminer le rôle du facteur de transcription Mesp1 dans la régulation du programme de différenciation cardiovasculaire et sur l’hétérogénéité des progéniteurs, ils ont également réalisé une analyse des gènes exprimés par les cellules progénitrices mutantes pour Mesp1. Ces expériences ont montré que le facteur Mesp1 est nécessaire à la sortie de l’état depluripotence et pour l’induction du programme d’expression des gènes cardiovasculaires. Les analyses bioinformatiques ont également identifié, parmi ces cellules progénitrices cardiaques précoces, différentes populations de cellules correspondant à des cellules progénitrices liées à différents types cellulaires et différentes régions du coeur. Ce constat a permis d’identifier les caractéristiques moléculaires associées à la ségrégation précoce vers une région ou un lignage cellulaire particulier du coeur. Enfin, les chercheurs ont identifié la ramification la plus précoce entre les lignages cardiaques musculaires et vasculaires au cours du développement embryonnaire : ils montrent que Notch1 marque spécifiquement les progéniteurs engagés vers le lignage vasculaire.
Alors que ces cellules progénitrices précoces ne sont pas encore différenciées, cette nouvelle analyse montre que les progéniteurs cardiovasculaires ont déjà initié leur programme pour devenir des cellules cardiaques musculaires ou vasculaires distinctes. Les chercheurs ont également montré que ces différentes populations de progéniteurs cardiovasculaires naissent à des étapes différentes et, surtout, ont une localisation bien précise au cours du développement embryonnaire précoce.
Comprendre les caractéristiques moléculaires associées avec l’engagement des progéniteurs précoces vers un lignage cardiovasculaire ou une région du coeur particuliers semble aujourd’hui extrêmement important pour concevoir de nouvelles stratégies de thérapie cellulaire des maladies cardiaques : la compréhension de ces mécanismes permettrait d’orienter les progéniteurs cardiovasculaires vers une identité cardiaque ou
vasculaire d’une région définie. « Des études complémentaires seront nécessaires afin de déterminer si le paradigme de la ségrégation précoce décrit dans cette étude contrôle également les différents lignages des autres organes et tissus. Il sera également important de déterminer si les acteurs moléculaires des progéniteurs cardiaques décrits ici ont un rôle dans l’apparition de malformations cardiaques congénitales et s’ils peuvent être utilisés pour guider les progéniteurs vers un lignage cardiaque particulier, ce qui aurait des implications importantes pour améliorer la thérapie cellulaire pour la réparation du coeur », commente Cédric Blanpain, un des auteurs principaux de cette étude.
Bertie Gottgens, l’autre auteur principal, affirme également: “Notre nouvelle découverte repose sur les innovations technologiques récentes qui nous permettent de déterminer l’activité d’expression des gènes dans chaque cellule individuellement. Non seulement ceci permet d’étudier des populations de cellules très réduites mais également, grâce aux outils bioinformatiques, de séparer les cellules uniques en différents sous-groupes, sur base de leur signature génétique. Grâce à ces nouveaux profils géniques, on peut à présent découvrir de nouveaux gènes candidats qui peuvent être exploités et utilisés dans le développement des thérapies cellulaires pour réparer le coeur, comme le mentionne le Pr Blanpain”.
Ce travail a été soutenu par le FNRS, la Fondation ULB, la Fondation Bettencourt Schueller, la Fondation Leducq au sein du réseau "22q11.2 deletion syndrome: Novel approaches to understand cardiopharyngeal pathogenesis", le Wellcome, Bloodwise, Cancer Research UK, NIH-NIDDK et par des financements du Wellcome -MRC Cambridge Stem Cell Institute.
Fabienne Lescroart a été soutenue financièrement par le FNRS, EMBO et la fondation Leducq. Cédric Blanpain est un chercheur WELBIO et est soutenu par un financement consolidator de Conseil Européen pour la Recherche (ERC).
Publication:
Fabienne Lescroart *, Xionan Wang *, Xionghui Lin *, Benjamin Swedlund, Souhir Gargouri, Adriana Sanchez-Dànes, Victoria Moignard, Christine Dubois, Catherine Paulissen, Sarah Kinston, Berthold Göttgens and Cédric Blanpain.
Defining the earliest step of cardiovascular lineage segregation by single cell RNA-seq. Science 2018
* indique une contribution équivalente
http://science.sciencemag.org/lookup/doi/10.1126/science.aao4174
DES CELLULES SOUCHES A UN COEUR FONCTIONNEL: LE RÔLE DU GENE Mesp1
First release Science Report: Les chercheurs de l’Université libre de Bruxelles et de l’Université de Cambridge ont découvert le rôle du gène clé Mesp1 dans les étapes les plus précoces de la formation du coeur lors de l’embryogénèse. Cette découverte pourrait aider à mieux comprendre les malformations cardiaques congénitales.
Le coeur est le premier organe formé au cours de l’embryogénèse. Il est constitué de plusieurs types cellulaires ayant des fonctions bien spécifiques : les cardiomyocytes, cellules assurant le battement du coeur, les cellules vasculaires tapissant l’intérieur des chambres et les vaisseaux sanguins et les cellules pacemakers assurant le rythme cardiaque. De très graves malformations cardiaques peuvent survenir si les cellules progénitrices à l’origine du coeur ne sont pas spécifiées au bon moment, ne migrent pas au bon endroit et ne se différencient pas correctement. Chez l’homme, les malformations cardiaques congénitales,
issues de défauts lors des étapes précoces du développement, représentent la cause la plus fréquente de mort à la naissance.
Des études précédentes ont montré que les cellules progénitrices cardiaques étaient issues de différentes populations de cellules exprimant un gène clé, Mesp1. Cependant, il restait à comprendre ce qui différenciait moléculairement ces populations distinctes et quels étaient les mécanismes moléculaires qui permettaient d’orienter les cellules progénitrices vers une région ou un type cellulaire particulier. Dans une nouvelle étude publiée dans la revue Science, les chercheurs dirigés par Cédric Blanpain, de l’Université libre de Bruxelles, et par Berthold Göttgens, de l’Université de Cambridge, ont identifié le rôle de Mesp1 dans les étapes les plus précoces de la spécification cardiovasculaire et ont défini les caractéristiques moléculaires des différentes populations de cellules progénitrices cardiaques. Ils ont pour cela utilisé la technologie de pointe de séquençage de tous les gènes exprimés par chaque cellule unique.
Fabienne Lescroart et ses collègues ont d’abord isolé, à différentes étapes du développement embryonnaire, les cellules progénitrices à l’origine du coeur exprimant Mesp1. Ils ont ensuite réalisé une analyse des gènes exprimés par chacune des cellules uniques afin d’identifier les caractéristiques moléculaires des cellules progénitrices associées avec une région ou un type cellulaire cardiaque particulier. Ils ont ainsi démontré que les différentes populations de progéniteurs cardiaques sont moléculairement distinctes. Afin de déterminer le rôle du facteur de transcription Mesp1 dans la régulation du programme de différenciation cardiovasculaire et sur l’hétérogénéité des progéniteurs, ils ont également réalisé une analyse des gènes exprimés par les cellules progénitrices mutantes pour Mesp1. Ces expériences ont montré que le facteur Mesp1 est nécessaire à la sortie de l’état depluripotence et pour l’induction du programme d’expression des gènes cardiovasculaires. Les analyses bioinformatiques ont également identifié, parmi ces cellules progénitrices cardiaques précoces, différentes populations de cellules correspondant à des cellules progénitrices liées à différents types cellulaires et différentes régions du coeur. Ce constat a permis d’identifier les caractéristiques moléculaires associées à la ségrégation précoce vers une région ou un lignage cellulaire particulier du coeur. Enfin, les chercheurs ont identifié la ramification la plus précoce entre les lignages cardiaques musculaires et vasculaires au cours du développement embryonnaire : ils montrent que Notch1 marque spécifiquement les progéniteurs engagés vers le lignage vasculaire.
Alors que ces cellules progénitrices précoces ne sont pas encore différenciées, cette nouvelle analyse montre que les progéniteurs cardiovasculaires ont déjà initié leur programme pour devenir des cellules cardiaques musculaires ou vasculaires distinctes. Les chercheurs ont également montré que ces différentes populations de progéniteurs cardiovasculaires naissent à des étapes différentes et, surtout, ont une localisation bien précise au cours du développement embryonnaire précoce.
Comprendre les caractéristiques moléculaires associées avec l’engagement des progéniteurs précoces vers un lignage cardiovasculaire ou une région du coeur particuliers semble aujourd’hui extrêmement important pour concevoir de nouvelles stratégies de thérapie cellulaire des maladies cardiaques : la compréhension de ces mécanismes permettrait d’orienter les progéniteurs cardiovasculaires vers une identité cardiaque ou
vasculaire d’une région définie. « Des études complémentaires seront nécessaires afin de déterminer si le paradigme de la ségrégation précoce décrit dans cette étude contrôle également les différents lignages des autres organes et tissus. Il sera également important de déterminer si les acteurs moléculaires des progéniteurs cardiaques décrits ici ont un rôle dans l’apparition de malformations cardiaques congénitales et s’ils peuvent être utilisés pour guider les progéniteurs vers un lignage cardiaque particulier, ce qui aurait des implications importantes pour améliorer la thérapie cellulaire pour la réparation du coeur », commente Cédric Blanpain, un des auteurs principaux de cette étude.
Bertie Gottgens, l’autre auteur principal, affirme également: “Notre nouvelle découverte repose sur les innovations technologiques récentes qui nous permettent de déterminer l’activité d’expression des gènes dans chaque cellule individuellement. Non seulement ceci permet d’étudier des populations de cellules très réduites mais également, grâce aux outils bioinformatiques, de séparer les cellules uniques en différents sous-groupes, sur base de leur signature génétique. Grâce à ces nouveaux profils géniques, on peut à présent découvrir de nouveaux gènes candidats qui peuvent être exploités et utilisés dans le développement des thérapies cellulaires pour réparer le coeur, comme le mentionne le Pr Blanpain”.
Ce travail a été soutenu par le FNRS, la Fondation ULB, la Fondation Bettencourt Schueller, la Fondation Leducq au sein du réseau "22q11.2 deletion syndrome: Novel approaches to understand cardiopharyngeal pathogenesis", le Wellcome, Bloodwise, Cancer Research UK, NIH-NIDDK et par des financements du Wellcome -MRC Cambridge Stem Cell Institute.
Fabienne Lescroart a été soutenue financièrement par le FNRS, EMBO et la fondation Leducq. Cédric Blanpain est un chercheur WELBIO et est soutenu par un financement consolidator de Conseil Européen pour la Recherche (ERC).
Publication:
Fabienne Lescroart *, Xionan Wang *, Xionghui Lin *, Benjamin Swedlund, Souhir Gargouri, Adriana Sanchez-Dànes, Victoria Moignard, Christine Dubois, Catherine Paulissen, Sarah Kinston, Berthold Göttgens and Cédric Blanpain.
Defining the earliest step of cardiovascular lineage segregation by single cell RNA-seq. Science 2018
* indique une contribution équivalente
http://science.sciencemag.org/lookup/doi/10.1126/science.aao4174